
发布时间:2026-01-06
摘要
背景:当归芍药散是一种常用的中药方剂,在治疗阿尔茨海默病方面已显示出临床疗效。本研究旨在探讨DSS及其拆方(酸甘汤与辛甘汤)在治疗AD中的疗效差异,以及DSS恢复AD自噬的机制。
方法:采用网络药理学策略阐述DSS在AD中的生物活性成分、相关靶点及调控机制,包括靶点预测、PPI网络构建与分析、GO和KEGG通路富集分析。采用脑室注射Aβ1-42诱导的AD小鼠模型,评估DSS及其拆方对AD的治疗效果。采用Morris水迷宫评估认知功能。通过RT-qPCR和ELISA定量炎症细胞因子表达水平。采用Western blot检测AD病理标志物及AMPK/mTOR信号通路相关蛋白的表达。
结果:从数据库和文献中筛选出50个活性化合物和718个HUB基因。KEGG和GO分析表明,DSS抗AD的潜在机制涉及AMPK/mTOR信号通路和线粒体自噬。体内动物实验结果表明,DSS、SG和XG治疗改善了小鼠的认知功能并减轻了神经炎症,缓解了神经元细胞的病理变化,提高了PSD-95蛋白水平,降低了APP和p-Tau水平。其中,DSS效果最佳。此外,DSS、SG和XG上调了LC3、Beclin1和p-AMPK的表达,同时降低了P62和p-mTOR的表达。
结论:DSS、SG和XG可能通过AMPK/mTOR自噬信号通路,改善了Aβ1-42注射小鼠的AD相关病理症状。
关键词:阿尔茨海默病;当归芍药散;自噬;AMPK/mTOR
本研究探讨了经典中药复方当归芍药散及其拆方(酸甘汤、辛甘汤)对阿尔茨海默病的治疗作用及机制。核心发现如下:
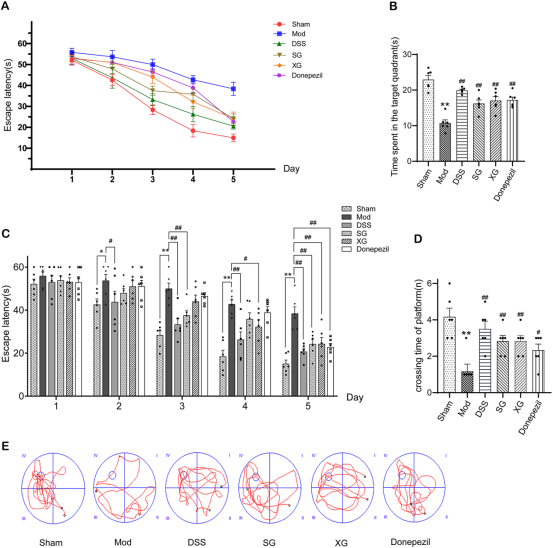
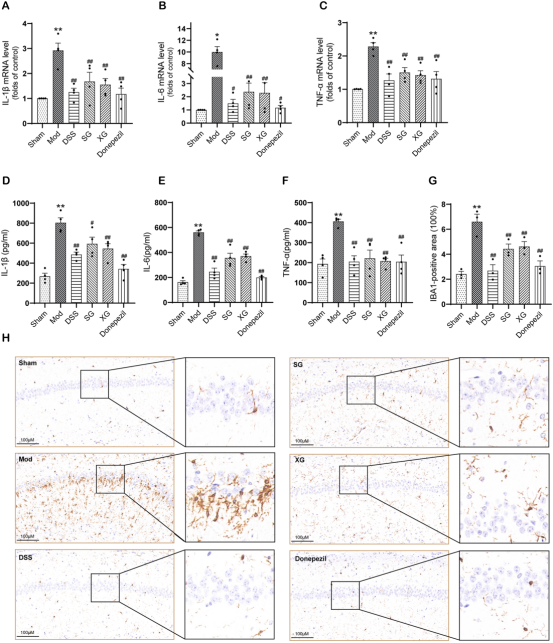
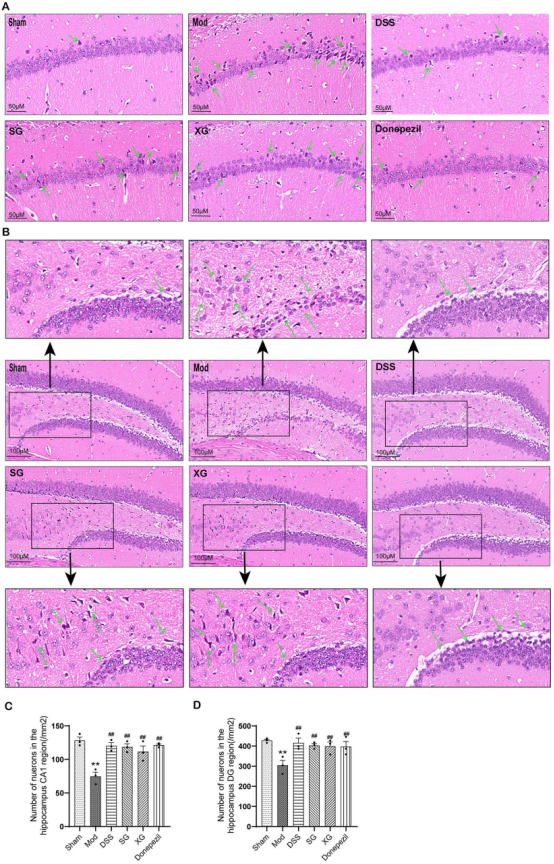
疗效验证:在Aβ1-42诱导的AD小鼠模型中,DSS及其拆方均能显著改善小鼠的空间学习记忆能力(Morris水迷宫测试),减轻神经炎症(降低IL-1β、IL-6、TNF-α水平及小胶质细胞标记物IBA1表达),改善海马神经元病理形态,上调突触蛋白PSD-95表达,并降低AD关键病理蛋白APP和p-Tau的水平。其中,全方DSS的改善效果最为显著。
作用机制:网络药理学分析预测DSS抗AD的潜在机制与AMPK/mTOR信号通路和自噬相关。实验验证表明,DSS及其拆方能上调自噬相关蛋白LC3-II和Beclin1的表达,下调自噬底物蛋白P62的表达,同时激活AMPK(增加p-AMPK)并抑制mTOR(减少p-mTOR),表明其能够恢复由Aβ诱导的自噬抑制,这一过程可能通过调控AMPK/mTOR信号通路实现。
方剂配伍意义:研究对比了全方DSS与拆方SG、XG的效果,发现全方疗效优于各拆方,体现了中药复方多成分、多靶点协同作用的“配伍”优势与理论精髓。
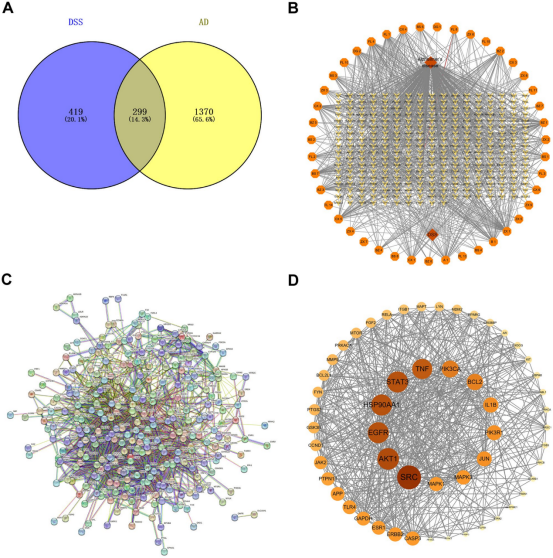
网络药理学预测:
从TCMSP数据库筛选DSS六味药材的活性成分(OB≥30%,DL≥0.18),并补充文献报道的有效成分,共得50个。
通过Swiss Target Prediction预测活性成分靶点。
从OMIM、GeneCards等疾病数据库获取AD相关靶点。
取药物靶点与疾病靶点的交集,得到299个DSS治疗AD的潜在关键靶点。
构建蛋白互作网络,筛选出核心靶点。
对关键靶点进行GO功能和KEGG通路富集分析,提示AMPK/mTOR信号通路和自噬是重要通路。
分子对接显示DSS主要活性成分(如芍药苷、阿魏酸、白术内酯III等)与AMPK、mTOR蛋白具有良好的结合活性。
体内动物实验验证:
模型建立:对C57BL/6J小鼠进行双侧脑室注射聚集态Aβ1-42,建立AD模型。
分组给药:分为假手术组、模型组、DSS组、酸甘汤组、辛甘汤组、阳性药多奈哌齐组。灌胃给药28天。
行为学评估:给药后第21天开始进行Morris水迷宫测试,评估学习记忆能力。
样本采集与分析:行为学测试后处死小鼠,取脑组织。
分子生物学:RT-qPCR和ELISA检测炎症因子(IL-1β, IL-6, TNF-α)的mRNA和蛋白水平;Western blot检测PSD-95、APP、p-Tau以及自噬(LC3, P62, Beclin1)和AMPK/mTOR通路(p-AMPK, p-mTOR)相关蛋白。
组织形态学:HE染色观察海马CA1和DG区神经元形态;免疫组化检测小胶质细胞标记物IBA1的表达。
总结:本研究综合运用网络药理学和实验验证,证实了当归芍药散能有效改善AD模型小鼠的认知功能障碍、神经炎症和神经元损伤,其神经保护作用可能与激活AMPK/mTOR信号通路、进而恢复细胞自噬功能有关。全方DSS的疗效优于其拆方,体现了中药复方整体治疗的优势。
展望与局限:
剂量关系:本研究未探讨不同给药剂量下的量效关系,未来可进一步细化。
机制深度验证:目前的研究结果主要为相关性证据,未来需要利用基因敲除、特异性抑制剂等反向验证手段,更直接地证实AMPK/mTOR自噬通路在DSS神经保护作用中的核心地位。
评估指标:对神经元和突触恢复的评估指标(如PSD-95)较为有限,未来应纳入更多元的突触前/后蛋白、电生理等指标进行全面评估。
模型拓展:本研究仅使用了Aβ脑室注射模型。为了增强结论的普适性,未来应在APP/PS1等转基因AD模型中进行验证。
成分与靶点:虽然网络分析筛选了成分和靶点,但具体是哪些成分通过哪些关键靶点驱动了核心通路,仍需进一步的细胞和分子实验深入解析。
IF3.3

Xiaoqing Cheng, Yuqiong Dai, Baoling Shang, Shuting Zhang, Liting Lin, Qingguang Wu, Ruoting Zhan, Shengqing Li, Sijun Liu
10.1186/s12906-024-04588-x;
BMC Complementary Medicine and Therapies
1.SYP-M0026Mouse IL-1β ELISA kit
2.SYP-M0031Mouse IL-6 ELISA kit
3.SYP-M0036Mouse TNF-α ELISA kit