

发布时间:2025-12-17
你的凝胶是不是也喜欢“搞艺术创作”?
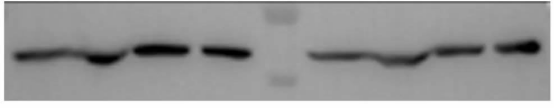
跑过WB的人都知道,理想中的电泳结果应该是:笔直整齐的marker条带,清晰锐利的样本条带,背景干净如画布。
但现实往往是:条带歪了、笑了、拖尾了,甚至直接“消失”了。每次打开凝胶观察窗,都像开盲盒——这次又会遇到什么“惊喜”?

今天,我们就来集中解答WB电泳中那些让人头疼的五大“怪现象”,让你的凝胶从此规规矩矩!
看起来像:条带两端向上弯曲,形成一个笑脸形状
主要原因:
电泳产热不均:凝胶中间温度高于两侧
凝胶厚度不均:灌胶时底部有气泡或不平整
缓冲液浓度不均:电泳液配制或补充不当
解决方案:
1. 降低电泳电压,减少产热
2. 确保灌胶均匀,避免气泡
3. 使用新鲜配制的电泳缓冲液
4. 夏季可在冷室进行电泳
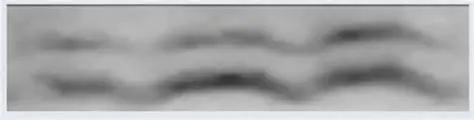
看起来像:条带两端向下弯曲,形成皱眉形状
主要原因:
凝胶底部温度过低:与“微笑”正好相反
凝胶聚合不均:底部聚合不完全
样品盐分过高:影响电泳迁移
解决方案:
1. 确保凝胶充分聚合(至少1小时)
2. 检查样品缓冲液是否合适
3. 适当提高电泳电压

看起来像:条带拖着长长的尾巴
主要原因:
蛋白过载:上样量太大
蛋白降解:样本处理不当或保存时间过长
溶解不充分:蛋白聚集未完全溶解
解决方案:
1. 减少上样量(通常20-50μg总蛋白足够)
2. 新鲜制备样本,避免反复冻融
3. 确保样本充分煮沸变性
4. 增加样本缓冲液中SDS浓度
看起来像:条带边界模糊,宽度异常
主要原因:
电泳时间过长:蛋白跑出最佳分离区
凝胶浓度不合适:孔径与蛋白大小不匹配
电压过低:分离时间过长
解决方案:
1. 根据蛋白大小优化凝胶浓度
2. 控制电泳时间,及时停止
3. 使用合适的电压(通常80-120V)
看起来像:凝胶上出现垂直的条纹
主要原因:
样品制备问题:存在不溶性颗粒
加样孔残留:上次胶的残留物
梳子拔出不当:损坏加样孔
解决方案:
1. 离心去除样本中不溶性物质
2. 仔细清洗梳子和玻璃板
3. 轻柔拔出梳子,避免损伤
看起来像:某些预期条带完全看不见
主要原因:
蛋白浓度过低:低于检测限
电泳条件不当:蛋白未进入分离胶
转膜失败:蛋白未转移到膜上
抗体问题:一抗或二抗失效
解决方案:
1. 浓缩样本或增加上样量
2. 检查电泳缓冲液和电压
3. 验证转膜效率(可用丽春红染色)
4. 确认抗体活性和特异性
看起来像:条带出现在预期分子量的上下位置
主要原因:
蛋白修饰:磷酸化、糖基化等改变迁移率
剪切变体:存在不同大小的异构体
二聚体/多聚体:未充分还原
marker不准:预染marker可能不准
解决方案:
1. 检查蛋白是否有已知修饰
2. 确保充分还原(使用新鲜DTT或β-巯基乙醇)
3. 验证marker准确性
4. 通过WB验证蛋白身份
第一步:样品检查
蛋白浓度测定是否准确?
样本是否新鲜制备?
还原剂是否新鲜有效?
第二步:凝胶检查
凝胶是否充分聚合?
浓度是否适合目标蛋白?
加样孔是否完整?
第三步:电泳条件检查
缓冲液是否新鲜配制?
电压设置是否合适?
电泳时间是否恰当?
第四步:对照设置
阳性对照是否正常?
marker条带是否清晰?
内参蛋白表现如何?
凝胶制备标准化
1. 使用固定配方和品牌试剂
2. 记录每次配胶的详细参数
3. 建立质量检查标准
电泳条件优化
1. 针对不同蛋白大小建立标准程序
2. 记录电压、时间、温度等参数
3. 定期校准电泳设备
样品处理规范化
1. 制定标准样品制备流程
2. 建立样品质量控制标准
3. 培训所有操作人员
解决了电泳问题,只是Western Blot成功的一半。电泳后的转膜、封闭、抗体孵育等环节同样重要,每个步骤都可能影响最终结果。

正如优品WB抗体系列所坚持的理念:可靠的实验结果需要每个环节的完美配合。我们的产品专为追求精准数据的科研工作者设计:
✔ 高特异性——条带清晰锐利,背景干净通透,有效避免非特异性结合造成的假阳性
✔ 高稳定性——4℃保存时间长,回收使用后信号衰减缓慢,确保实验结果的重复性和可比性
✔ 多种包装规格——提供小包装(如10μL试用装),方便条件摸索和预实验,避免珍贵试剂的浪费
✔ 覆盖全面——从常规内参到磷酸化抗体,从常见靶点到稀有蛋白,提供一站式的WB抗体解决方案
记住,一次完美的WB实验,从优质的电泳开始,到可靠的抗体检测结束。每个环节都值得精心对待。
掌握电泳问题解决技巧,让您的WB实验从起点就一帆风顺!欢迎关注我们,获取更多WB实验的实用技巧与专业解决方案。