

发布时间:2025-07-09
做Western Blot(WB)的小伙伴们,可能都遇到过这样的灵魂拷问:“细胞上清液里的蛋白能用WB检测吗?”
有人说:“当然可以!我做过!”
也有人摇头:“不行,信号太弱,结果不可靠。”
那到底行不行?今天咱们就来掰扯清楚,顺便聊聊怎么让实验结果更靠谱!
细胞上清液,简单来说就是细胞培养一段时间后,去掉细胞剩下的液体。这里面可能包含:
细胞主动分泌的蛋白(比如细胞因子、激素、外泌体等)
细胞被动释放的蛋白(比如细胞损伤或死亡后漏出来的胞内蛋白)
培养基里的血清蛋白(如果用的是含血清培养基,比如10% FBS,里面会有大量牛血清蛋白)所以,WB能不能检测到目标蛋白,首先得看它是不是真的存在于上清液里!
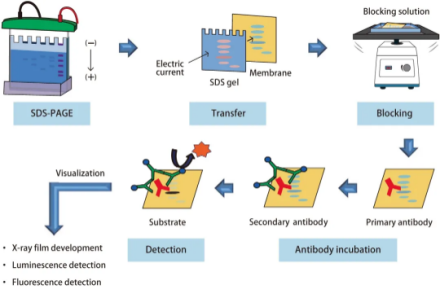
细胞分泌的蛋白量通常远低于胞内蛋白,比如某些细胞因子可能只有pg/mL级别,而WB的检测下限一般在ng级别。直接跑WB?很可能啥也看不见!
解决方案:
✅ 浓缩上清液——超滤离心、丙酮/TCA沉淀、冻干浓缩等
✅ 提高上清液体积(比如收集更多培养液)
✅ 选择高灵敏度抗体(推荐用化学发光法,别用肉眼可见的显色法)
如果培养基里含血清(比如10% FBS),上清液里会混入大量牛血清蛋白(BSA、IgG等),它们可能在WB里形成高背景,甚至和目标蛋白分子量接近,导致条带分不清。
解决方案:
✅ 换用无血清培养基(比如Opti-MEM、SFM)
✅ 提前饥饿处理细胞(用无血清培养基培养几小时,减少血清蛋白干扰)
✅ 跑WB前用BSA封闭,减少非特异结合
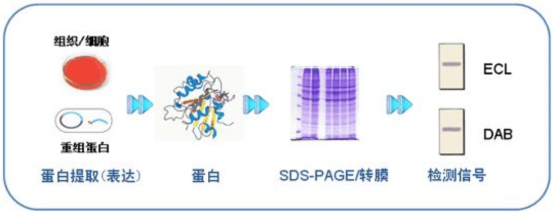
上清液里的蛋白没有细胞保护,更容易被蛋白酶降解。如果你收完上清液放4°C隔夜再测,可能目标蛋白早就被分解得渣都不剩了……
解决方案:
✅ 收上清液后立刻加蛋白酶抑制剂(如PMSF、cocktail)
✅ 尽快处理样本,避免反复冻融
✅ 低温保存(-80°C),减少降解
如果你不确定目标蛋白是否真的分泌到上清液里,可以先做个胞内WB,确认细胞确实表达这个蛋白。然后再对比上清液,看看是否能检测到。
空白培养基对照(排除血清干扰)
细胞裂解液对照(确认抗体能结合目标蛋白)
敲除/敲低细胞对照(如果可能,用CRISPR或siRNA敲除目标基因,看看上清液条带是否消失)
降低抗体稀释度(比如1:500→1:200)
延长曝光时间(但要注意背景信号)
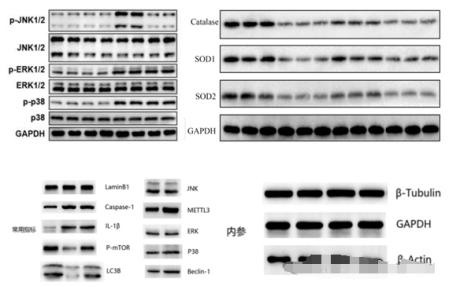
✅ 可以测,但要看目标蛋白的表达水平(高分泌蛋白如IL-6、TNF-α相对容易,低丰度蛋白可能测不到)
✅ 必须优化实验条件(浓缩样本、减少干扰、防止降解)
✅ 对照实验一定要做,否则结果可能只是“美丽的误会”
其实,有时候不是实验方案不行,而是抗体不够给力!
�� 优品生物抗体,专为低丰度蛋白检测优化,高特异性、低背景,让你的WB条带清晰可见!
✅ 高亲和力抗体——精准识别目标蛋白,减少杂带干扰
✅ 严格质控——每批抗体均经过WB验证,确保稳定性
✅ 多种应用验证——适用于细胞上清、组织裂解液等复杂样本
别再让模糊的条带折磨你的实验!试试优品生物抗体,让WB结果更可靠!